1. 花色表型评估
为了表征牡丹花色发育,我们在早期花蕾到盛开的五个发育阶段对黄花品种“海黄”和紫红色花品种“肉芙蓉”进行了取样(图1a,b),并且在S1-S5发育阶段测量了两品种的花瓣颜色指数(图1c,d)。在“海黄”中,我们发现L *(明度)值从S1到S5逐渐增加,这表示花瓣颜色明度升高。C *(色度)和b *(黄色)在S3达到峰值,随后在S4和S5下降,证明S3是颜色最黄的阶段。与L *、C *和b *相比,h(色相角)在S1至S3阶段降低,然后在S4和S5略有增加。对于“肉芙蓉”来说,在整个开花过程中没有观察到L *的显著变化。h在S1至S3阶段下降,然后在S4和S5中急剧增加。S3至S5的h值为~0°(360°),与紫红色一致。与h类似,在“肉芙蓉”中C *也在S1至S3阶段降低,并且在后面的S4和S5阶段增加。与花色一致,在S1到S5阶段,“肉芙蓉”中b *显著低于“海黄”。同样,“肉芙蓉”中a *比“海黄”要高得多。
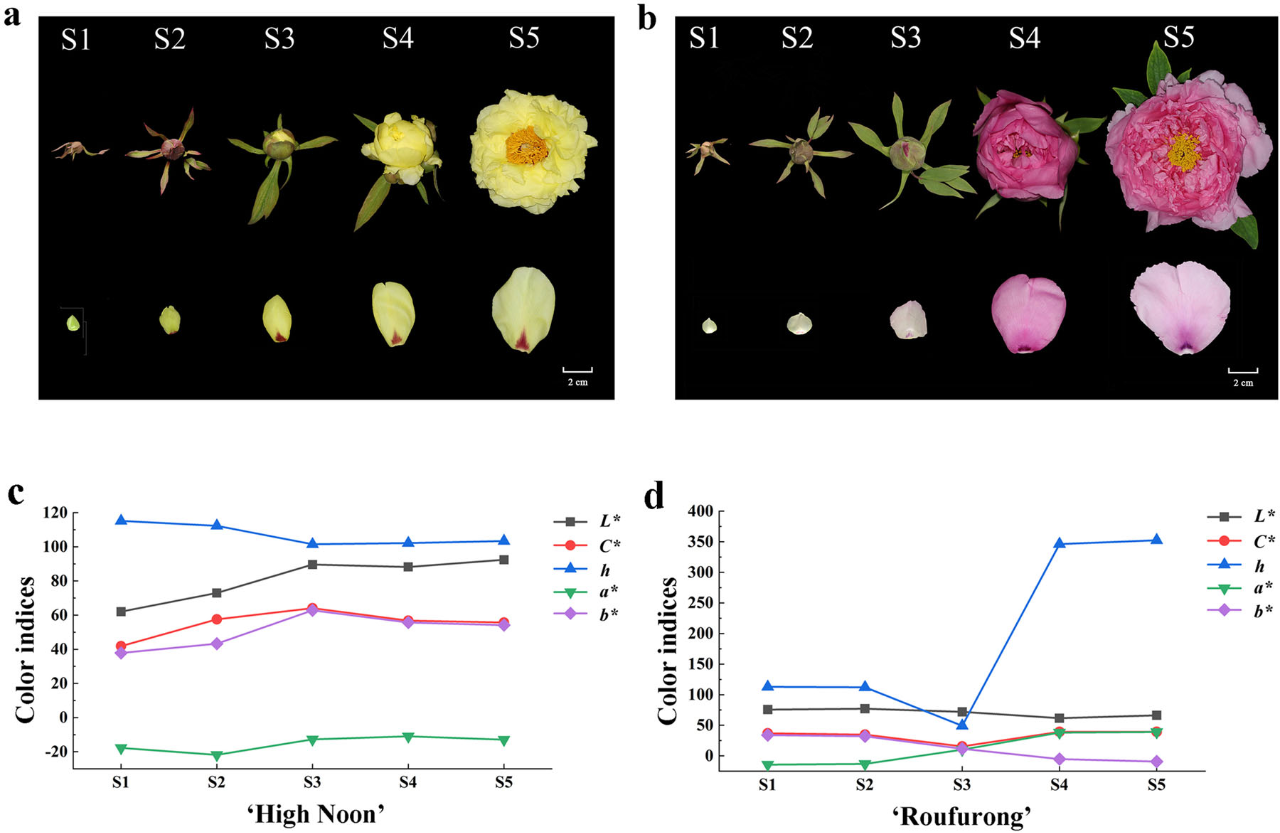
图1 a, “海黄”品种花表型。b, “肉芙蓉”品种花表型。c, “海黄”颜色指数。d, “肉芙蓉”颜色指数。S1:第1阶段,无颜色的芽;S2:第2阶段,略微着色的软芽;S3:第3阶段,初花;S4:第4阶段,开了一半的花;S5:第5阶段,完全打开着色的花,具有暴露的花药。L *代表明度,随着值的增加,颜色变得更加亮。C *代表色度,随着值升高,颜色饱和度会增加。h表示色相角,定义如下:0°(360°)表示紫红色,90°表示黄色,180°表示蓝绿色,270°表示蓝色。a *和b *分别代表红色和黄色。
2. 黄酮类化合物的定量分析
我们在每个发育阶段的两个牡丹品种之间观察到黄酮含量的显著变化。如图2a,b所示,“海黄”中靶向黄酮类化合物在S1至S3阶段显著增加,然后在S4和S5略微下降。在S3-S5开花后期阶段,THC的含量显著高于其他黄酮类化合物。Ap和Km在五个开花阶段都有相似的含量。此外,Ch和Is的含量大致相同。而且,在整个开花过程中,“海黄”中没有检测到花青素。相比之下,我们在“肉芙蓉”中检测到三种花青素,其中主要是芍药素3-O-葡糖苷(Pn3G),其随着花朵绽放逐渐增加,并在S5阶段达到最大水平,说明Pn3G可能有助于紫红色着色。与“海黄”相比,THC、Is、Ap含量在前4个阶段呈快速上升趋势,在S5阶段呈中度下降趋势,它们的变化范围比花葵素3-O-葡糖苷(Pg3G)的变化范围相对小。相反,我们发现Lu、Km、Qu、花青素3-O-葡糖苷(Cy3G)的含量没有明显的变化,因此,这些组分可能对于紫红色着色没有显著影响。
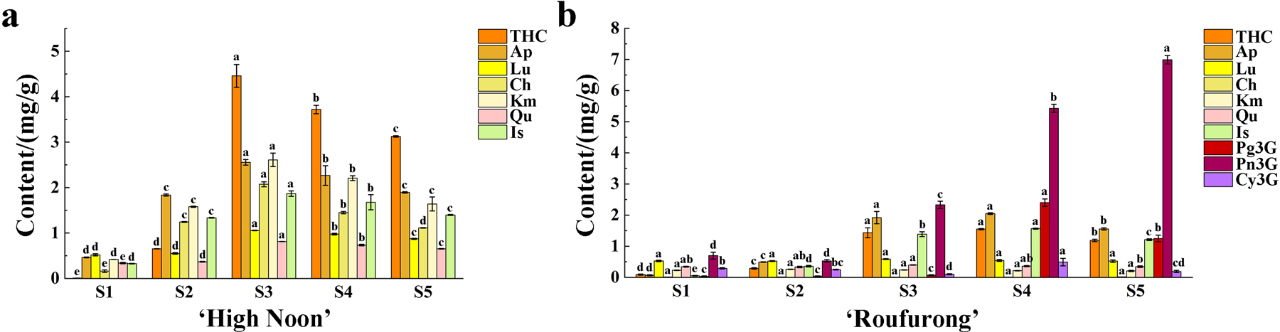
图2 a, “海黄”;b, “肉芙蓉”。误差线表示三个生物重复的平均值。不同字母(a-d)表示不同黄酮类化合物中的显著差异(P <0.05)。THC,四羟基查耳酮;Ap,芹黄素;Lu,木樨草素;Ch,金圣草黄素;Km,山柰酚;Qu,槲皮素;Is,异鼠李素;Pg3G,花葵素 3-O-葡糖苷;Pn3G,芍药素 3-O-葡糖苷; Cy3G,花青素 3-O-葡糖苷。
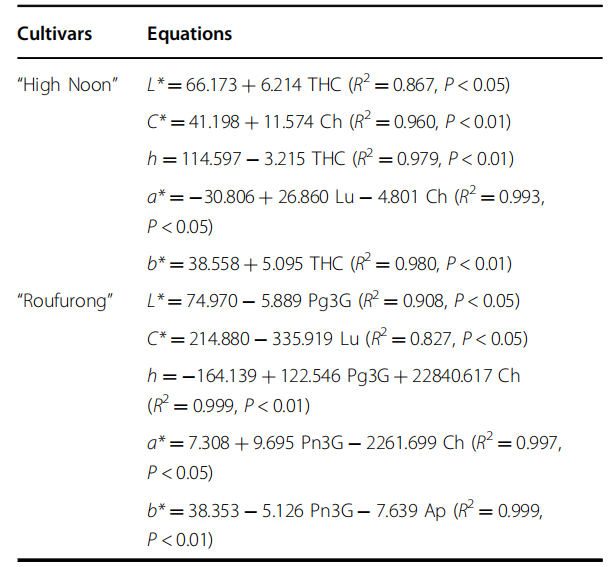
为了解花卉颜色和黄酮类组分之间的关系,我们进行了多元线性回归(MLR)分析(表1)。在“海黄”品种中,L *和b *与THC水平呈正相关,表明THC含量的增加导致了黄色的积累。相反,h值与THC水平呈负相关。Ch与C *正相关,与a *负相关。因此,THC和Ch可能与黄色花的产生相关联。在“肉芙蓉”中,Pg3G与L *负相关,而与h正相关,表明高含量的Pg3G可能导致花瓣的低亮度。此外,C *与Lu含量呈负相关,这可能是影响花瓣饱和度的一种色素。此外,我们发现a *分别与Pn3G和Ch呈正相关,而b *与Pn3G和Ap具有负相关性。这些结果表明,高含量的Pn3G和低含量的Ch对于花瓣的紫红色至关重要。考虑到THC和Ch在“海黄”的S3阶段具有最高累积水平,C *和b *也在S3时达到峰值,我们进一步选择S3阶段进行后续转录组分析以鉴定黄色着色的候选基因。
表1 “海黄”和“肉芙蓉”两牡丹品种的多元线性回归方程
3. 转录组测序概述
我们对“海黄”和“肉芙蓉”两牡丹品种S1-S5阶段10个花瓣样品进行TGS测序。我们总共获得473,062误差校正ROIs,平均读取长度为1,883 bp。此外,我们认为76.1%全长ROIs是FLNC读数,在过滤低质量共识序列后获得117,680种高质量亚型。S3阶段两个品种花瓣组织的转录组分析采用SGS方法,试验进行三次生物学重复。六个库覆盖45.88 Gb高Q30(> 94%)的clean read数据。总共有56,610个ORFs被映射到组装中,其中41,138个显示全长序列。为了估测组装序列的功能,我们通过搜索不同的数据库来注释56,974个转录本。我们发现,牡丹转录本与葡萄高度相似(27.40%),更多的转录本富集在生物过程,比如代谢过程、细胞过程和单生物过程。此外,我们将27,265转录本映射到125个代谢途径。在黄酮类生物合成途径(ko00941)、花青素生物合成途径(ko00942)以及黄酮和黄酮醇生物合成途径(ko00944)中分别存在115、12和30个转录本。
4. 参与类黄酮生物合成的DEGs
为了鉴定黄色着色的候选基因,我们鉴定了S3阶段“海黄”和“肉芙蓉”的DEGs。与“海黄”相比,有16,017个DEGs上调,有13,527个DEGs下调(图3a)。GO富集分析显示,15,796个DEGs分布于51个条目,包括21个生物学过程,16个细胞组分和14个分子功能。在最大的类别生物学过程中,DEGs显著富集在“代谢过程”、“细胞过程”和“单体生物过程”(图3b)。我们筛选了涉及黄酮类生物合成的DEGs发现,有45个结构基因(2 PsC4Hs、8 PsCHSs、3 PsCHIs、12 PsF3Hs、2 PsF3’Hs、11 PsFLSs、4 PsDFRs和3 PsUFGTs以及5个TF基因PsMYB4 (F01_cb7851_c8)、PsMYB111 (F01_cb8732_c11)、PsTT8 (F01_cb3692_c7)、PsEGL3 (F01_cb8475_c28561)和PsSPL9 (F01_cb9156_c0)。我们将与黄酮类生物合成相关的DEGs的表达谱在图4中展示出来。然后,我们随机选择12个基因进行qRT-PCR以验证转录组数据。我们发现它们的表达水平与RNA-seq数据结果一致。
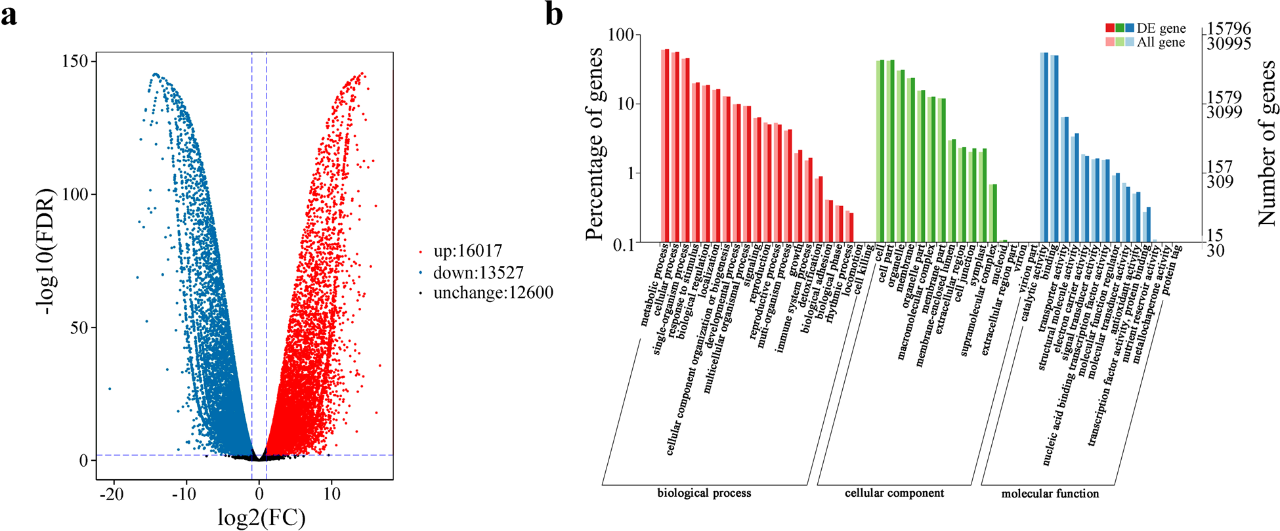
图3 “肉芙蓉”和“海黄”基因库差异表达基因分析
a, DEGs火山图。b, DEGs GO富集分析。
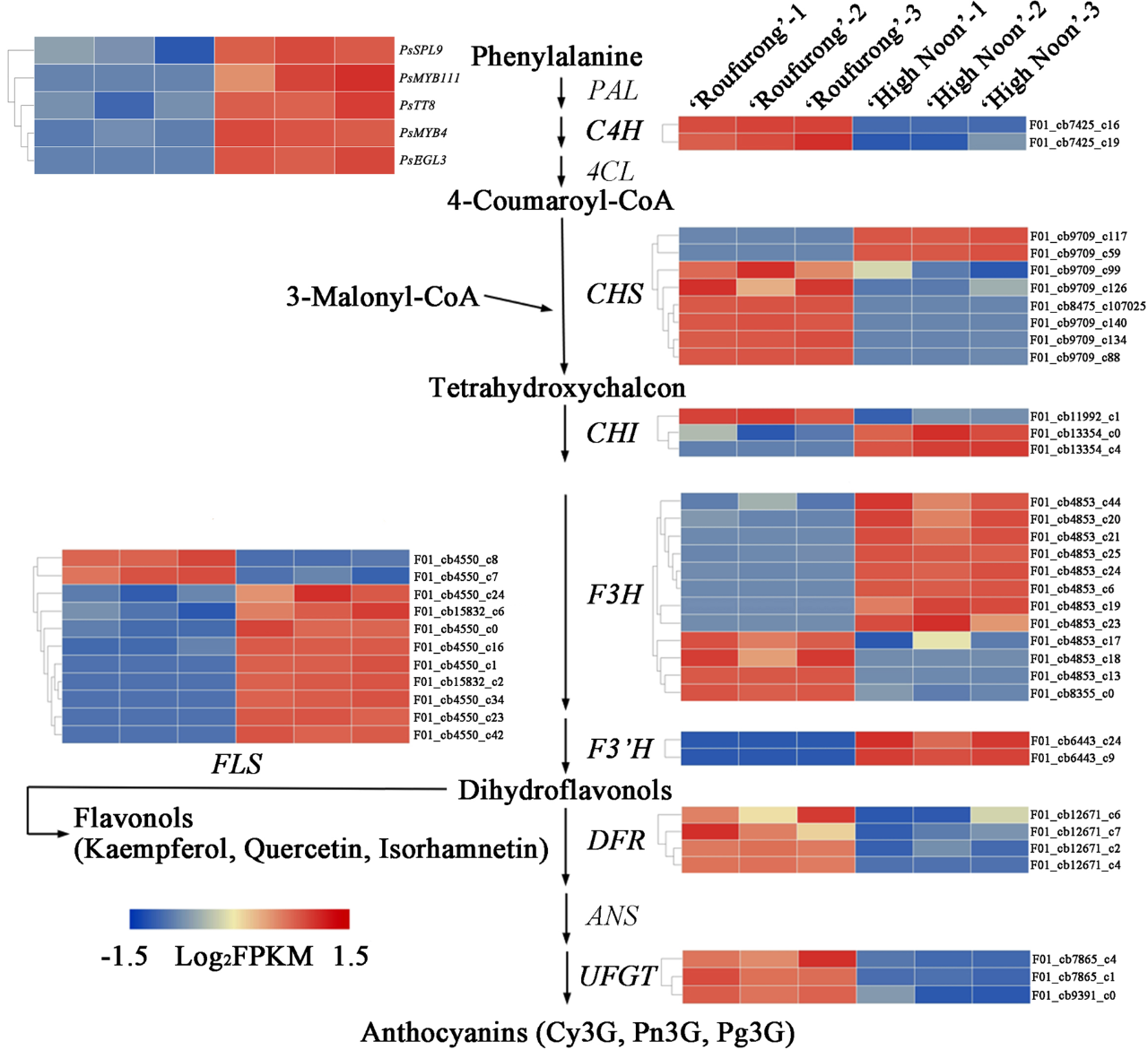
图4 S3阶段“海黄”和“肉芙蓉”黄酮类生物合成途径中DEGs及其表达水平
每个基因的表达模式在每个步骤旁边的热线图中示出。蓝色表示低表达和红色表示高表达。
如图4所示,“海黄”黄酮类生物合成第二阶段的结构基因比“肉芙蓉”表达水平高。这些基因包括两个PsCHSs(F01_cb9709_c117和F01_CB9709_C59)和两个PsCHIs(F01_CB13354_C0和F01_CB13354_C4)。基于基因注释,PsCHS在合成THCs中有重要作用,而PsCHI在产生黄酮过程中发挥关键作用,这有助于黄色着色。此外,在“海黄”中8个假定PsF3Hs基因(F01_cb4853_c44、F01_cb4853_c20、F01_cb4853_c21、F01_cb4853_c25、F01_cb4853_c24、F01_cb4853_c6、F01_cb4853_c19和F01_cb4853_c23),2个PsF3'Hs基因(F01_cb6443_c24和F01_cb6443_c9)和9 PsFLSs基因(F01_cb4550_c24、F01_cb15832_c6、F01_cb4550_c0、F01_cb4550_c16、F01_cb4550_c1、F01_cb15832_c2、F01_CB4550_C34、F01_CB4550_C23和F01_CB4550_C42)也有很高的转录水平。在这些基因中,PsFLS可以改变黄酮类途径,以促进黄酮醇的合成。“海黄”和“肉芙蓉”中这些表达的变化与“海黄”中高水平的THC、黄酮和黄酮醇一致。与第二阶段的结构基因对比,我们发现在黄酮类生物合成的第三阶段,“海黄”中4个PsDFRs基因(F01_cb12671_c6、F01_cb12671_c7、F01_cb12671_c2和F01_cb12671_c4)和3个PsUFGTs基因(F01_cb7865_c4、F01_cb7865_c1和F01_cb9391_c0)显著下调。PsDFR和PsUFGT在花青素合成中起关键作用,如Cy3G,Pn3G和Pg3G的生物合成。因此,PsDFRs和PsUFGTs在“海黄”的下调可以解释这种黄色花卉品种中缺乏花青素的产生。
我们还通过“海黄”和“肉芙蓉”的转录组分析了调节黄酮类生物合成的TF基因。如图4所示,所有这些鉴定的TFs基因都在具有黄色花的“海黄”品种中上调。MYB和bHLH TFs之间的相互作用可以调节黄酮类生物合成途径中的结构基因。我们在拟南芥中用MyBs分析鉴定与黄酮类生物合成相关的候选MYB蛋白。结果表明,PsMYB4属于拟南芥的亚组4(S4)。拟南芥中的S4 MyBs直接与AtbHLHs(TT8、GL3和EGL3)相互作用并抑制MBW复合物的转录活性,从而导致花青素和苯丙素合成的抑制。PsMYB111被列为S7,其在拟南芥中调节黄酮醇生物合成。序列分析显示,PsMYB4和PsMYB111是典型的R2R3MYB蛋白,PsMYB4含有保守序列[D/E]LX2[K/R]X3LX6LX3R,其与bHLH蛋白相互作用。我们发现,虽然PsMYB111不与bHLH相互作用,但在C端SG7基序[K/R][R/X][R/K]XGRT[S/X][R/G]XX[M/X]K和SG7-2基序[W/X][L/X]LS是特有的黄酮醇生物合成调节剂。就bHLHs而言,我们在S5亚组中鉴定了PsTT8和PsEGL3,它们与黄酮类生物合成有关。PsTT8和PsEGL3均包含一个N末端MYB相互作用区域(MIR)、一个bHLH结构域和一个C末端假定ACT-like结构域。MIR表明PsTT8和PsEGL3可以与MYB蛋白相互作用,并且假定ACT-like结构域在bHLHs的二聚化中发挥至关重要作用。此外,系统发育分析表明,含有典型的Squamosa启动子结合蛋白结构域的PsSPL9与ATSPL9和ATSPL15聚集在一起,其中AtSPL9通过破坏拟南芥MBW复合体的稳定性来抑制花青素的积累。
5. 类黄酮生物合成相关候选基因的表达模式
我们使用了qRT-PCR分析,调查了“海黄”和“肉芙蓉”S1-S5五个开花阶段花瓣的结构基因PsC4H(F01_cb7425_c19)、PsCHS(F01_cb9709_c126)、PsCHI(F01_cb13354_c0)、PsF3H(F01_cb4853_c44)、PsF3'H(F01_cb6443_c9)、PsFLS(F01_cb4550_c24)和PsDFR(F01_cb12671_c6 )以及TF基因PsMyB4、PsMYB111、PsTT8、PsEGL3和PsSPL9的表达模式(图5a)。对于结构基因来说,在“肉芙蓉”中仅PsC4H和PsDFR表达水平较高,其与花青素的积累一致(图2b)。相反,其他选定的结构基因,PsCHS、PsCHI、PsF3H、PsF3'H和PsFLS均在“海黄”中有更高的表达。此外,来自S1-S5阶段的这些基因的表达模式与先前确定的黄酮类积累规律一致(图2a)。S3阶段PsCHS转录水平大大上调,在S4和S5阶段也保持高表达,而PsCHI的表达在S2阶段达到峰值,然后在S3、S4和S5阶段显著降低。S3至S5阶段PsCHS的高表达和PsCHI的低表达导致了THC的积累。另外,S3、S4和S5阶段PsF3H、PsF3'H和PsFLS的高表达可能影响了代谢流,有利于黄酮醇的产生,例如Km、Qu和Is。我们还发现,在“海黄”中PsFLS和PsDFR基因表达呈负相关,这表明两个基因之间存在潜在竞争机制。对于TF基因来说,在“海黄”中PsMYB4、PsEGL3和PsSPL9基因具有一致的表达模式,先增加,然后在以后的阶段下降。这种模式与PsDFR的表达模式相反。在“海黄”中PsMyB111和PsTT8的表达模式类似,在S2阶段达到峰值,在S3阶段显著下降,然后在S4和S5阶段略微增加。这种表达模式与PsCHI和PsFLS基因完全匹配,也验证了PsMYB111可以直接调节这两个结构基因转录水平的假设。
基于基因表达和类黄酮累积曲线,我们做出了TF基因与编码黄酮类化合物结构基因之间的相互作用网络图(图5b)。结果表明,PsPL9与PsDFR和PsC4H呈负相关。PsMYB4和PsEGL3基因以及PsMYB111和PsTT8基因之间有很强的正相关关系。这四种TF基因是整个相互作用网络的中心基因。交互网络还表明PsFLS与PsMYB111和PsTT8密切相关,也直接与Km、Qu和Is相关。尽管如此,PsMYB111已被确定为缺乏bHLH作用位点;因此,我们假设PsMYB111基因可以通过单独调节PsFLS的表达来影响黄酮醇的产生。为了验证该假设,我们选择PsMYB111以进行后续功能分析。
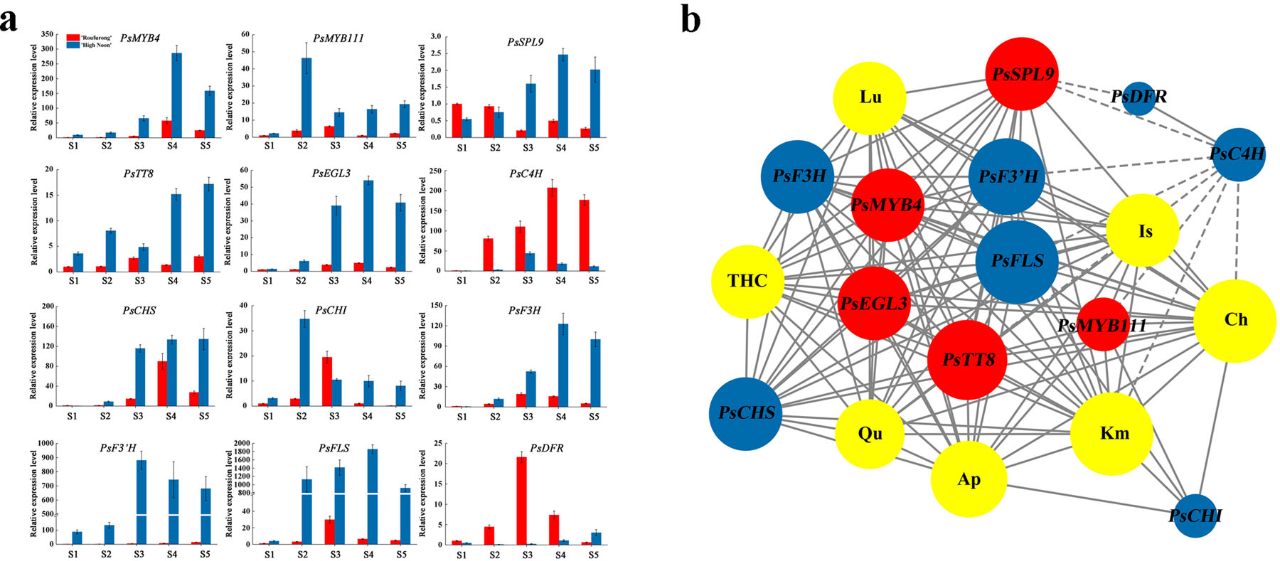
图5 “海黄”和“肉芙蓉”在五个开花阶段花瓣中转录因子(TF)基因和结构基因的表达分析
a, “海黄”和“肉芙蓉”在五个开花阶段花瓣中所选基因的表达模式。b,所选基因与黄酮类化合物之间的相互作用网络。红色代表TF基因,蓝色代表结构基因,黄色代表黄酮类化合物。实线表示正相关,虚线表示负相关。更大的圆圈和更多节点表示更强的相关性。
6. PsMYB111的亚细胞定位分析
为了探讨PsMYB111的亚细胞定位,我们构建了含有与绿色荧光蛋白(GFP)融合的PsMyB111的质粒,并瞬时转入烟草叶片中,在72小时后观察蛋白质的亚细胞定位。我们特异性地检测核中融合蛋白PsMYB111-GFP的荧光(图6a,b),发现PsMYB111作为一个TF基因参与调节黄酮醇生物合成。
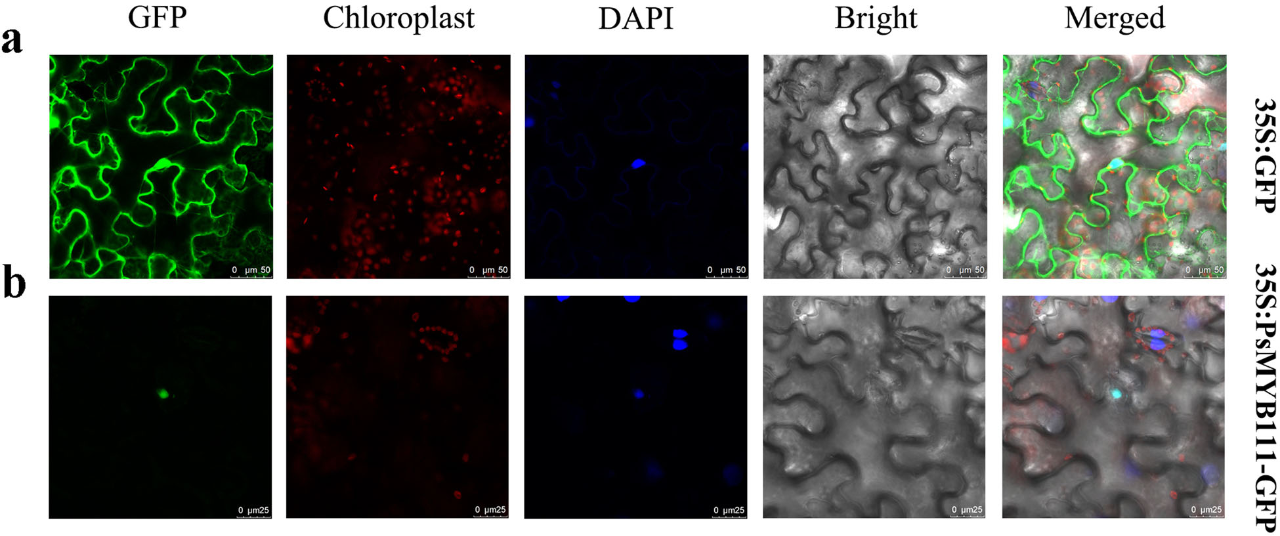
图6 PsMYB111融合蛋白在烟草叶片中的亚细胞定位分析
a, 在烟草叶片表皮细胞中表达的对照载体(pCAMBIA1302-GFP)。b, 在烟草叶片表皮细胞中表达的重组载体(PsMYB111-GFP)。GFP,GFP荧光;Chloroplast,叶绿体荧光;DAPI,DAPI荧光;Bright,明视野;Merged,叠加明视野和荧光。标尺,25和50 μm。
7. PsMYB111在烟草中的过表达
为了进一步表征PsMYB111在黄酮生物合成中的功能,我们构建过表达PsMYB111(PsMYB111 OE)的转基因烟草系,并且获得了两个T2系(OE-1和OE-2)。与WT的玫瑰红色颜色相比,OE-1和OE-2的花色是浅粉色(图7a)。OE-1具有比OE-2更高的PsMyB111转录水平,因此我们选择它进一步研究(图7a)。通过测定烟草花瓣的颜色指数L *、a *、C *和h,我们发现,OE-1的L *值显著高于WT,而a*和C *的值显著降低(P<0.01)(图7b)。相应地,与WT相比,THC、Ap、Lu、Km和Qu的含量也显著增加,而Pg3G和Pn3G含量显著降低(P <0.01)(图7c)。这些结果与转基因烟草的颜色表型一致。
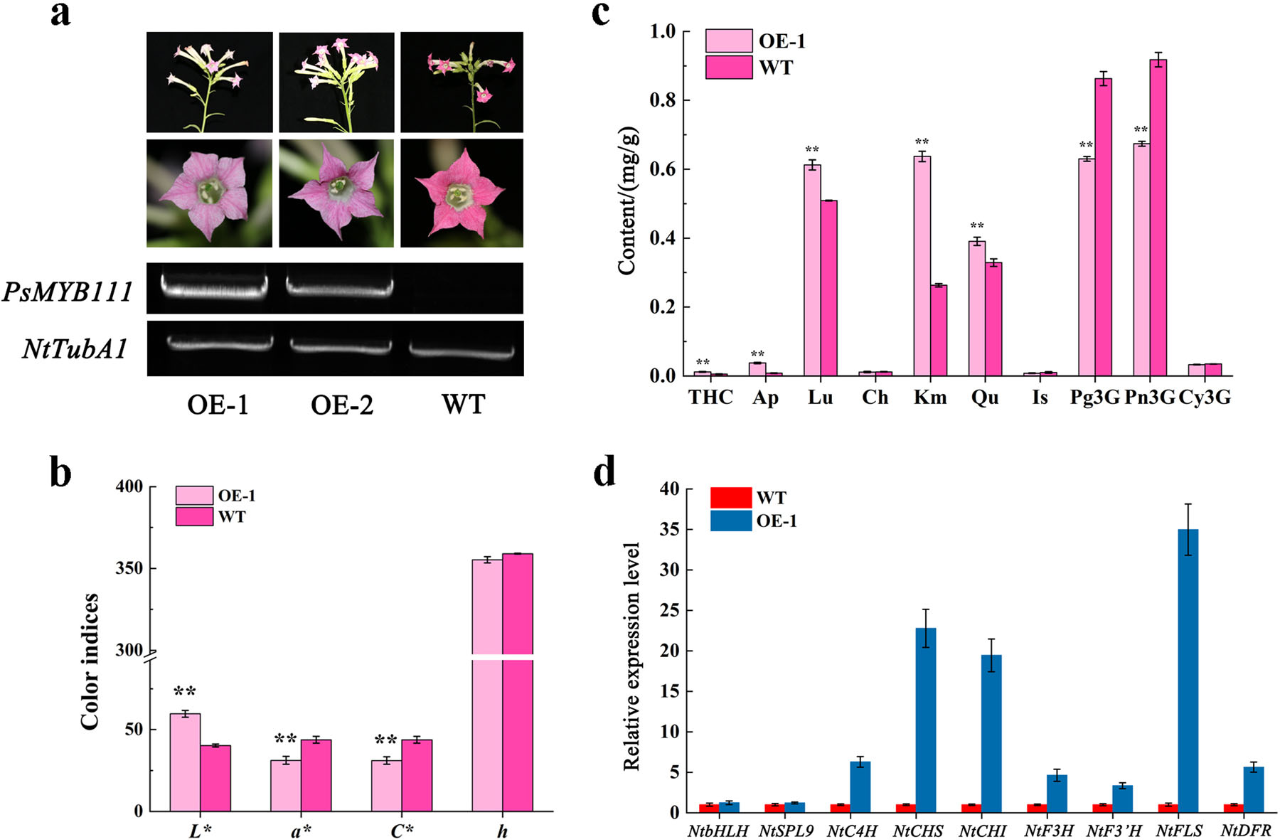
图7 PsMYB111过表达增加了烟草中黄酮醇的积累,减少了花青素的积累
a, 来自野生型(WT)和转基因烟草的花及其相应PsMYB111转录水平。NtTubA1用作内源性对照。b, 来自WT和转基因烟草的花瓣颜色指数。c, WT和转基因烟草花瓣中的类黄酮含量。d, WT和转基因烟草花瓣中内源性TF基因和黄酮类生物合成基因的表达模式。对每个样品进行三次独立实验。数据显示为平均值±标准差。** p<0.01。
为了研究PsMYB111是否可以调节黄酮类生物合成结构基因的转录,我们使用qRT-PCR分析了OE-1花瓣中所选结构基因的表达(图7d)。结果表明,与WT相比,NtCHS、NtCHI和NtFLS的转录显著增加,而NtC4H、NtF3H、NtF3'H和NtDFR仅略微上调。NtFLS的上调是所分析结构基因中最高的。此外,NtbHLH和NtSPL9表现出与WT类似的表达丰度。同时,PsMYB111可以单独调节结构基因的表达,而不是在复合体中,并且其可提高黄酮的积累量,例如Qu和Km。
8. PsMYB111对PsCHS和PsFLS启动子的调控
烟草叶片转基因实验表明,PsMYB111可直接调节NtCHS和NtFLS。为了验证其对PsCHS和PsFLS的调节作用,我们对PsCHS(750bp)和PsFLS(1,010bp)启动子序列进行了测序,并分析了它们的顺式作用元件(图8a)。我们鉴定出许多与MYB和bHLH TFs相关的cis-作用元件,包括MYB结合位点(5'-CAACNG-3')、bHLH结合位点(5'-CATGTG-3')和G-box(5 '-CACGTG-3')(图8a),这显示出他们与PsMYB111的潜在相互作用。
为了进一步证实该假设,我们应用了双荧光素酶测定法,将携带PsMYB111的pGreenII62-SK载体作为效应载体,将携带PsCHS和PsFLS启动子的pGreenII0800 LUC载体作为报告载体。在烟草叶片中TF和启动子共侵染后,我们检测到LUC / REN比值。如图8b所示,与相应的对照相比,PsMYB111-PsCH和PsMYB111-PsFLS构建体具有更高的LUC / REN比,达显著差异水平,这表明PsMYB111可以激活PsCHS和PsFLS的启动子。PsMYB111对PsFLS(2.59倍)的激活强度比PsCHS(1.58倍)强,这表明PsMYB111可以优先调节PsFLS的转录。
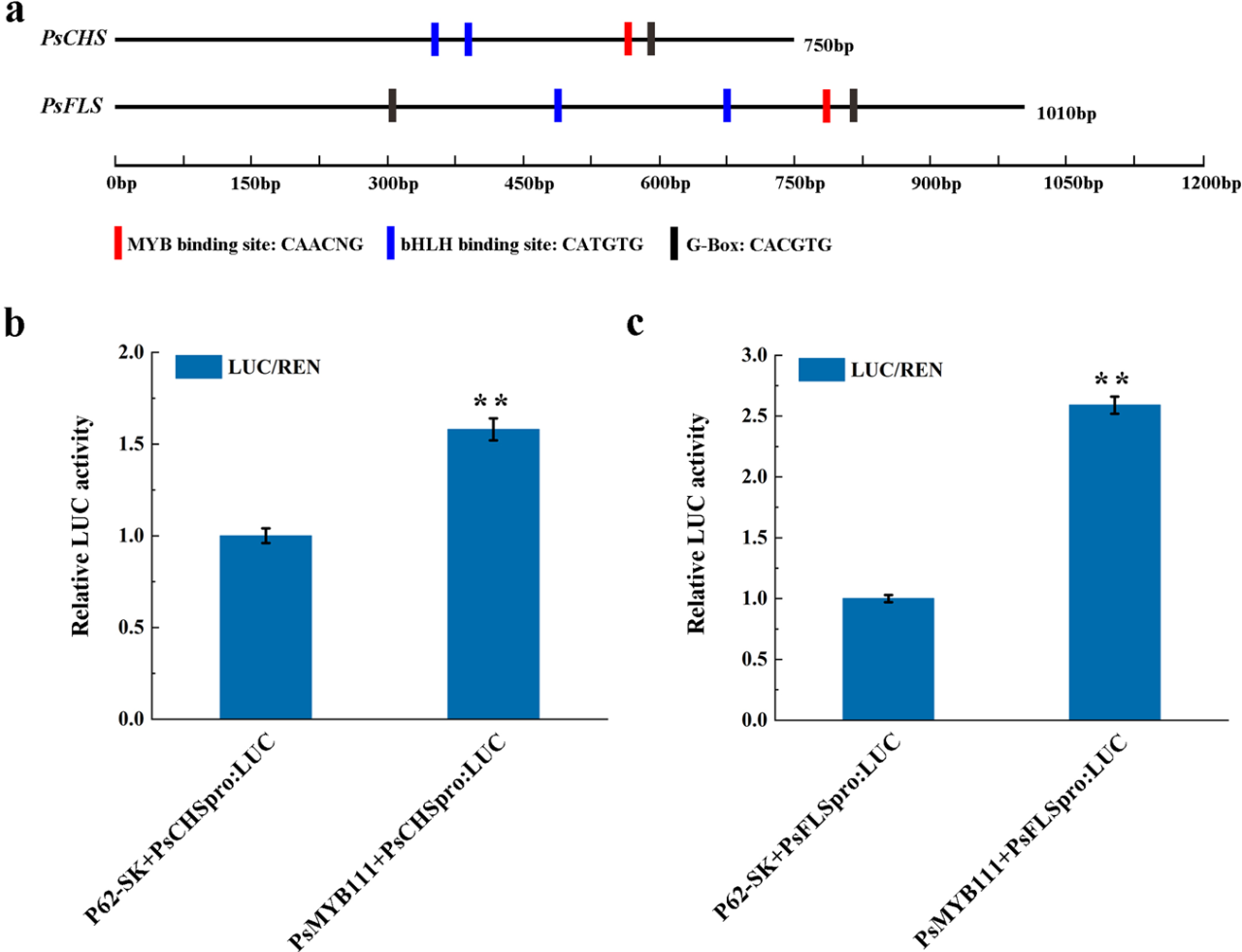
图8 PsMYB111对牡丹PsCHS和PsFLS启动子的转录活性分析
a, PsCHS和PsFLS启动子的概述。b, 烟草叶片双荧光素酶测定。转化的原生质体作为对照,其仅含一个没有效应体的启动子-LUC报道载体。数据代表三个独立实验三次重复的平均值±标准差。** p <0.01。
牡丹的纯黄色花极为罕见,其黄色着色的分子机制仍不清楚。本试验我们选择了具有黄花的“海黄”作为研究材料,将具有紫红色花的“肉芙蓉”作为对照。我们对“海黄”花瓣的花卉颜色表型和黄酮类化合物代谢谱进行了研究,并且结合了全长和比较转录组分析,通过功能分析进一步验证了黄色着色的候选基因。
黄酮类化合物在不同植物器官的着色中发挥着关键作用。在这项研究中,我们表明,“海黄”花中THC、黄酮(Ap、Lu和Ch)和黄酮醇(Km、Qu和Is)含量明显高于“肉芙蓉”。在“海黄”的黄色花瓣组织中没有检测到花青素。在云南的黄花牡丹中也有类似的结果,其也含有丰富的THC、ISP、Km、Qu、Is、Ch和Ap。在这些化合物中,THC和Ch是导致黄色的主要成分。研究认为,高含量的查尔酮2’葡萄糖苷是牡丹中黄花表型的重要原因。在“肉芙蓉”中,显性花青素Pn3G的积累是形成紫红色花瓣最有可能的原因。据报道,花青素含量的降低增加了L *值并减少了a *值,导致两种草本牡丹品种“落日珊瑚”和“夏威夷珊瑚粉”的花朵从珊瑚变为粉红色,然后变为黄色。此外,在“金衣花脸”和“霞光”开花期间花青素出现急剧下降,从红色到橙色,然后到黄色。因此,不含花青素的高THC、黄酮和黄酮醇含量可能对“海黄”花的黄色着色至关重要。
在黄酮类生物合成途径中,CHS催化关键中间体THC的合成,其可以通过CHI进一步异构化,导致黄酮和黄酮醇的产生。据先前报道,PlCHI在芍药品种“黄金轮”中的低表达可诱导查尔酮积累并产生黄色。在本研究中,我们假设S3-S5期间“海黄”中PsCHS的高表达和PsCHI的低表达有助于THC的大量累积,这也会导致黄色着色。另外,S3至S5阶段“海黄”中PsF3H、PsF3'H和PsFLS的高表达促进了向黄酮醇(Km、Qu和Is)的合成。在白色葡萄风信子花朵中,当FLS上调时,用于合成花青素的底物就可以用于合成山奈酚。PsDFR和PsUFGT的下调与“海黄”中缺乏花青素积累一致。我们在芍药中也观察到,其花瓣中PlDFR、PlANS、Pl3GT和Pl5GT的低表达抑制了花青素的产生,导致黄色色素的形成。值得注意的是,FLS和DFR之间的底物竞争机制可能导致花青素和黄酮醇合成的变化,因为FLS加强了二氢黄酮醇向黄酮醇的通量,最终限制了花青素的积累。在本研究中,我们还观察到FLS和DFR之间的竞争,这可能也是“海黄”黄花表型的原因之一。“海黄”中FLS表达上调可能消耗二氢黄酮醇作为底物,从而增加黄酮醇的积累,减少DFR分支花青素的积累;在芍药中也发现了类似的结果,在近白花中PoFLS4表达上调,二氢黄酮醇向黄酮醇转化。葡萄风信子FLS和DFR对DHM的竞争可能抑制飞花翠素的合成,从而改变黄酮醇与花青素的比例,进一步消除蓝色着色。对甘蓝的最新研究也表明,山奈酚积累的差异可能是由FLS的表达水平引起的。相比之下,在四川独蒜兰着色花朵中PlDFR转录增加伴随着PlFLS转录的减少,导致花青素增加。此外,FLS和DFR之间的竞争机制也是杨梅花青素缺乏的原因之一。
MYB和bHLH是调节植物黄酮类生物合成的关键转录因子TFs。在本研究中,我们鉴定了几个差异表达的MYB和bHLH转录因子,每一个都与牡丹黄酮类的产生有关。其中,PsMYB4被鉴定为具有bHLH相互作用位点的负黄酮类调节剂,这意味着它们可能形成一个复杂的负调控下游结构基因。在拟南芥中,三突变体Atmyb4/7/32与野生型植物相比,花青素和苯丙素积累增加,这与我们的结果一致。我们还观察到PsDFR和PsC4H与PsSPL9呈显著负相关。高表达的PsSPL9和低表达的PsDFR可能抑制了“海黄”花青素的产生。同样,拟南芥中的AtSPL9转录因子也被证明能够抑制花青素生物合成基因的表达,尤其是DFRs。此外,芍药花组织中的黄色可能通过抑制PlPAL、PlFLS、PlDFR、PlANS、Pl3GT和Pl5GT而受到miR156e -3p靶向SPL1的调控。对于PsMYB111和PsTT8来说,尽管它们表现出一致的表达模式(图5a),但PsMYB111最有可能不与bHLH相互作用。基于同源聚类,PsMYB111属于拟南芥的S7 MYBs,已被证实在黄酮类通路中正向调节早期生物合成基因,如CHSs、CHIs、F3Hs、F3’Hs和FLSs。拟南芥S7中的AtMYB11、AtMYB12和AtMYB111功能独立于bHLHs。在欧洲葡萄的研究中,也有人提出了一个类似的调控模型,即VvMYBF1是VvFLS1的特异性激活剂并导致黄酮醇积累。在本研究中,我们观察到PsMYB111与PsFLS转录之间存在明显的关联。PsMYB111通过单独调节PsFLS促进黄酮醇的积累。此外,PsMYB4和PsEGL3可能形成复合物负调控部分结构基因,而PsSPL9可能单独负调控PsDFR,抑制花青素的产生。
亚细胞定位分析显示PsMYB111定位于细胞核(图6a,b),表明PsMYB111可能在细胞核中发挥TF的作用。PsMYB111在烟草中的过表达使其花颜色由玫瑰红变为浅粉色。转基因烟草株系中Km、Qu等黄酮醇含量显著增加,而Pg3G、Pn3G等花青素含量显著降低,证实了其在黄色牡丹花着色中的作用。在非洲菊中,GhMYB1a过表达还导致Km-型黄酮醇产量显著增加,花青素产量显著减少。在我们PsMYB111过表达系中,我们观察到黄酮醇和花青素含量呈负相关关系,这反映了这两种代谢通量之间的竞争。S7 MYBs异源表达可调控黄酮类生物合成基因的表达,特别是通过上调黄酮醇类通路基因,引起黄酮醇合成,抑制花青素生成。与黄酮醇水平升高一致,烟草中PsMYB111过表达导致NtCHS、NtCHI和NtFLS表达增加(图7d)。已有研究表明,黄酮醇基因(PAL、CHS、CHI、F3H和FLS)在过表达黄酮醇特异性MYB TF基因的转基因烟草中普遍上调。三花龙胆中GtMYBP3和GtMYBP4的过表达促进了烟草和拟南芥黄酮醇生物合成基因的表达。此外,在GhMYB1a过表达的转基因烟草株系中,NtCHS、NtF3H和NtFLS的表达显著上调,GhMYB1a显著激活了非洲菊GhDFR和GhMYB10的NtCHS和NtFLS启动子。同样,我们发现PsMYB111对PsCHS和PsFLS启动子,尤其是PsFLS有显著的激活作用(图8b, c)。
综上所述,我们的研究表明PsMYB111可能通过直接调控PsFLS的表达,降低花青素合成通量,从而影响黄酮醇的积累,最终促进牡丹黄花的形成。本研究不仅为研究牡丹黄酮类生物合成的调控机制提供了新的思路,而且发现了一种可能用于黄花牡丹分子育种的MYB调控因子。此外,PsMYB4可能通过负调控部分结构基因与PsEGL3相互作用减少花青素的合成,而PsSPL9可能通过单独负调控PsDFR抑制花青素的积累。这些候选调节者的功能需要进一步研究。